
sábado, 29 de enero de 2011
Regla del octeto (8e-). [ Torres Ortiz Tatiana Arisai]
La regla del octeto, enunciada en 1917 por Gilbert Lewis, dice que la tendencia de los átomos de los elementos del sistema periódico es complementar sus últimos niveles de energía con ocho electrones.
Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos enlaces determinara el comportamiento y las propiedades de las moléculas, estas propiedades dependerán del tipo de enlace, del numero de enlaces por átomo, y de las fuerzas intermoleculares.
Estructura de Lewis. [ Torres Ortiz Tatiana Arisai]
La Estructura de Lewis también llamada diagrama de punto o modelo de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que pueden existir.
El diagrama de Lewis puede ser usado tanto para representar moléculas formadas por la unión de sus átomos mediante enlace covalente.
La estructura de Lewis fue propuesta por Gilbert Lewis, quien la introdujo en 1915 en su articulo La molécula y el átomo.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y lineas que se trazan entre los átomos que se unen entre si. En ocasiones, para representar cada enlace, se usan pares de puntos en lugar de lineas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una linea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
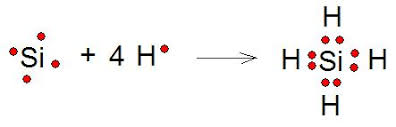
El diagrama de Lewis puede ser usado tanto para representar moléculas formadas por la unión de sus átomos mediante enlace covalente.
La estructura de Lewis fue propuesta por Gilbert Lewis, quien la introdujo en 1915 en su articulo La molécula y el átomo.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y lineas que se trazan entre los átomos que se unen entre si. En ocasiones, para representar cada enlace, se usan pares de puntos en lugar de lineas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una linea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
martes, 18 de enero de 2011
Ejercicios de configuración electrónica normal o basal [Torres Ortiz Tatiana Arisai]
82Pb:〖1s〗^(2 ) 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^2
Escribir la configuración electrónica (normal o basal) de los siguientes elementos:
-Bromo
35Br:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^5
-Magnesio
12Mg:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2
-Renio
75Re:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^5
-Rubidio
37Rb:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^1
-Indio
49In:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^1
-Xenón
54Xe:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6
-Tulio
69Tm:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^13
-Berkelio
97Bk:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^6 〖7s〗^2 〖5f〗^9
-Estaño
50Sn:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^2
-Fosforo
15P:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^3
-Polonio
84Po:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^4
-Bario
56Ba:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2
Escribir la configuración electrónica (normal o basal) de los siguientes elementos:
-Bromo
35Br:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^5
-Magnesio
12Mg:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2
-Renio
75Re:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^5
-Rubidio
37Rb:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^1
-Indio
49In:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^1
-Xenón
54Xe:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6
-Tulio
69Tm:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^13
-Berkelio
97Bk:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^6 〖7s〗^2 〖5f〗^9
-Estaño
50Sn:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^2
-Fosforo
15P:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^3
-Polonio
84Po:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^4
-Bario
56Ba:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2
Tipos de Enlace (Ana Karen Esquivel Gutierrez)
En 1916, el químico americano Gilbert Newton Lewis propusó que los enlaces químicos se formaban entre los átomos porque los electrones de los átomos interactuaban entre ellos. Lewis había observado que muchos elementos eran más estables cuando ellos contenían ocho electrones en su envoltura de valencia. El sugirió que los átomos con menos de ocho valencias de electrones se enlazaban para compartir electrones y completar sus envolturas de valencia.
Mientras que algunas de las predicciones de Lewis han sido desde entonces probadas como incorrectas (el sugirió que los electrones ocupaban orbitas en forma de cubos), su trabajo estableció la base de lo que se conoce hoy en día sobre los enlaces químicos. Sabemos que hay dos principales tipos de enlaces químicos, iónicos y - enlaces covalentes
ENLACE IONICO
El enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
ENLACE COVALENTE
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
En realidad, hay dos sub tipos de enlaces covalente. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar .
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos. Los enlaces polares covalentes ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar covalente, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace hidrógeno - oxígeno en la molécula de agua.
Mientras que algunas de las predicciones de Lewis han sido desde entonces probadas como incorrectas (el sugirió que los electrones ocupaban orbitas en forma de cubos), su trabajo estableció la base de lo que se conoce hoy en día sobre los enlaces químicos. Sabemos que hay dos principales tipos de enlaces químicos, iónicos y - enlaces covalentes
ENLACE IONICO
El enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
ENLACE COVALENTE
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
En realidad, hay dos sub tipos de enlaces covalente. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar .
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos. Los enlaces polares covalentes ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar covalente, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace hidrógeno - oxígeno en la molécula de agua.
domingo, 16 de enero de 2011
Configuracion electronica. (Marin Rodriguez Luis Angel)
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.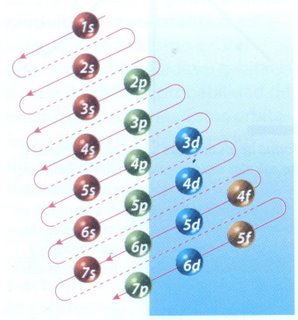

Teoria de la relatividad general. (Marin Eodriguez Luis Angel)

Einstein en el laboratorio
Teoría de la relatividad general
La teoría de la relatividad general se refiere al caso de movimientos que se producen con velocidad variable y tiene como postulado fundamental el principio de equivalencia, según el cual los efectos producidos por un campo gravitacional equivalen a los producidos por el movimiento acelerado.
La revolucionaria hipótesis tomada por Einstein fue provocada por el hecho de que la teoría de la relatividad especial, basada en el principio de la constancia de la velocidad de la luz sea cual sea el movimiento del sistema de referencia en el que se mide (tal y como se demostró en el experimento de Michelson y Morley), no concuerda con la teoría de la gravitación newtoniana: si la fuerza con que dos cuerpos se atraen depende de la distancia entre ellos, al moverse uno tendría que cambiar al instante la fuerza sentida por el otro, es decir, la interacción tendría una velocidad de propagación infinita, violando la teoría especial de la relatividad que señala que nada puede superar la velocidad de la luz.
Tras varios intentos fallidos de acomodar la interacción gravitatoria con la relatividad, Einstein sugirió de que la gravedad no es una fuerza como las otras, sino que es una consecuencia de que el espacio-tiempo se encuentra deformado por la presencia de masa (o energía, que es lo mismo). Entonces, cuerpos como la tierra no se mueven en órbitas cerradas porque haya una fuerza llamada gravedad, sino que se mueven en lo más parecido a una línea recta, pero en un espacio-tiempo que se encuentra deformado por la presencia del sol.
Los cálculos de la relatividad general se realizan en un espacio-tiempo de cuatro dimensiones, tres espaciales y una temporal, adoptado ya en la teoría de la relatividad restringida al tener que abandonar el concepto de simultaneidad. Sin embargo, a diferencia del espacio de Minkowsy y debido al campo gravitatorio, este universo no es euclidiano. Así, la distancia que separa dos puntos contiguos del espacio-tiempo en este universo es más complejo que en el espacio de Minkowsky.
Con esta teoría se obtienen órbitas planetarias muy similares a las que se obtienen con la mecánica de Newton. Uno de los puntos de discrepancia entre ambas, la anormalmente alargada órbita del planeta Mercurio, que presenta un efecto de rotación del eje mayor de la elipse (aproximadamente un grado cada diez mil años) observado experimentalmente algunos años antes de enunciarse la teoría de la relatividad, y no explicado con las leyes de Newton, sirvió de confirmación experimental de la teoría de Einstein.
Un efecto que corroboró tempranamente la teoría de la relatividad general es la deflexión que sufren los rayos de luz en presencia de campos gravitatorios. Los rayos luminosos, al pasar de una región de un campo gravitatorio a otra, deberían sufrir un desplazamiento en su longitud de onda (el Desplazamiento al rojo de Einstein), lo que fue comprobado midiendo el desplazamiento aparente de una estrella, con respecto a un grupo de estrellas tomadas como referencia, cuando los rayos luminosos provenientes de ella rozaban el Sol.
La verificación se llevó a cabo aprovechando un eclipse total de Sol (para evitar el deslumbramiento del observador por los rayos solares, en el momento de ser alcanzados por la estrella); la estrella fue fotografiada dos veces, una en ausencia y otra en presencia del eclipse. Así, midiendo el desplazamiento aparente de la estrella respecto al de las estrellas de referencia, se obtenía el ángulo de desviación que resultó ser muy cercano a lo que Einstein había previsto.
El concepto de tiempo resultó profundamente afectado por la relatividad general. Un sorprendente resultado de esta teoría es que el tiempo debe transcurrir más lentamente cuanto más fuerte sea el campo gravitatorio en el que se mida. Esta predicción también fue confirmada por la experiencia en 1962. De hecho, muchos de los modernos sistemas de navegación por satélite tienen en cuenta este efecto, que de otro modo darían errores en el cálculo de la posición de varios kilómetros.
Otra sorprendente deducción de la teoría de Einstein es el fenómeno de colapso gravitacional que da origen a la creación de los agujeros negros. Dado que el potencial gravitatorio es no lineal, al llegar a ser del orden del cuadrado de la velocidad de la luz puede crecer indefinidamente, apareciendo una singularidad en las soluciones. El estudio de los agujeros negros se ha convertido en pocos años en una de las áreas de estudio de mayor actividad en el campo de la cosmología.
Precisamente a raíz de la relatividad general, los modelos cosmológicos del universo experimentaron una radical transformación. La cosmología relativista concibe un universo ilimitado, carente de límites o barreras, pero finito, según la cual el espacio es curvo en el sentido de que las masas gravitacionales determinan en su proximidad la curvatura de los rayos luminosos. Sin embargo Friedmann, en 1922, concibió un modelo que representaba a un universo en expansión, incluso estático, que obedecía también a las ecuaciones relativistas de Einstein. Con todo, la mayor revolución de pensamiento que la teoría de la relatividad general provoca es el abandono de espacio y tiempo como variables independientes de la materia, lo que resulta sumamente extraño y en apariencia contrario a la experiencia. Antes de esta teoría se tenía la imagen de espacio y tiempo, independientes entre sí y con existencia previa a la del Universo, idea tomada de Descartes en filosofía y de Newton en mecánica.
Teoria de la relatividad. (Marin Rodriguez Luis Angel)

Einstein
Teoría de la relatividad especial
Los postulados de la relatividad especial son dos. El primero afirma que todo movimiento es relativo a cualquier otra cosa, y por lo tanto el éter, que se había considerado durante todo el siglo XIX como medio propagador de la luz y como la única cosa absolutamente firme del Universo, con movimiento absoluto y no determinable, quedaba fuera de lugar en la física, que no necesitaba de un concepto semejante (el cual, además, no podía determinarse por ningún experimento).
El segundo postulado afirma que la velocidad de la luz es siempre constante con respecto a cualquier observador. De sus premisas teóricas obtuvo una serie de ecuaciones que tuvieron consecuencias importantes e incluso algunas desconcertantes, como el aumento de la masa con la velocidad. Uno de sus resultados más importantes fue la equivalencia entre masa y energía, según la conocida fórmula E=mc², en la que c es la velocidad de la luz y E representa la energía obtenible por un cuerpo de masa m cuando toda su masa sea convertida en energía.
Dicha equivalencia entre masa y energía fue demostrada en el laboratorio en el año 1932, y dio lugar a impresionantes aplicaciones concretas en el campo de la física (tanto la fisión nuclear como la fusión termonuclear son procesos en los que una parte de la masa de los átomos se transforma en energía). Los aceleradores de partículas donde se obtiene un incremento de masa son un ejemplo experimental clarísimo de la teoría de la relatividad especial.
La teoría también establece que en un sistema en movimiento con respecto a un observador se verifica una dilatación del tiempo; esto se ilustra claramente con la famosa paradoja de los gemelos: "imaginemos a dos gemelos de veinte años, y que uno permaneciera en la Tierra y el otro partiera en una astronave, tan veloz como la luz, hacia una meta distante treinta años luz de la Tierra; al volver la astronave, para el gemelo que se quedó en la Tierra habrían pasado sesenta años; en cambio, para el otro sólo unos pocos días".
Teoria cuantica (Marin Rodriguez Luis Angel)

La Teoría Cuántica es uno de los pilares fundamentales de la Física actual. Se trata de una teoría que reúne un formalismo matemático y conceptual, y recoge un conjunto de nuevas ideas introducidas a lo largo del primer tercio del siglo XX, para dar explicación a procesos cuya comprensión se hallaba en conflicto con las concepciones físicas vigentes.
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
Bohr (Marin Rodriguez Luis Angel)
Niels Henrik David Bohr (Copenhague, Dinamarca; 7 de octubre de 1885 – ibídem; 18 de noviembre de 1962) fue un físico danés que realizó fundamentales contribuciones para la comprensión de la estructura del átomo y la mecánica cuántica.
Nació en Copenhague, hijo de Christian Bohr, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Mánchester a las órdenes de Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
Después de la guerra, abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en 1962.

Nació en Copenhague, hijo de Christian Bohr, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Mánchester a las órdenes de Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
Después de la guerra, abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en 1962.

Niveles de energia atomicos. (Marin Roriguez Luis Angel)
NIVELES DE ENERGIA.
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Así pues. el átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
Na -> Na+
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Así pues. el átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
Na -> Na+
Orbitales atomicos (Marin Rodriguez Luis Angel)
Los numeros cuanticos son s, p, d, f.
“ n “ = representa los niveles de energía. (desde 1 hasta 7)
“ l “ = representa las formas geométricas de los orbitales (de cero hasta n-1)
“ m “ = representa la orientación en el espacio de estos orbitales (desde – l hasta + l pasando por cero )
“ s” = representa el sentido de giro del electrón sobre su propio eje ( + ½ y – ½
Según el “principio de exclusión de Pauli” solo dos electrones pueden ocupar cada orbital .”.
S : una sola orientación: S : 2 electrones
P: tres orientaciones : Px, Py, Pz : 6 electrones
d: cinco orientaciones: d1, d2, d3, d4, d5 : 10 electr.
f: siete orientaciones: f1…f7 : 14 electrones
1S2
2S2 2P6
3S2 3P6 3d10
4S2 4P6 4d10 4f14
5S2 5P6 5d10 5f 14 5g
6S2 6P6 ---------------------
7S2 ------------------------------
sábado, 15 de enero de 2011
Número atómico: modelo atómico con núcleo (protones) y electrones. [Torres Ortiz Tatiana Arisai]
Después de que Dalton postula su teoría atómica, los investigadores tuvieron la oportunidad de estudiar la naturaleza discontinua de la materia desde una nueva perspectiva.
en el curso de las investigaciones se fueron acumulando evidencias experimentales que no podían explicarse con el modelo atómico de Dalton.
por ejemplo, en 1897 Joseph John Thompson, físico inglés, demostró la existencia de particulas más pequeñas que exhibían caga negativa, a las cuales denomino electrones. las evidencias experimentales indicaban que los electrones provenían de los atómos, y ponían de manifiesto que el modelo propuesto por Dalton era incorrecto. En 1905, Thomson propone un nuevo modelo atómico.
Un año después el propio Thomson detecta otro tipo de partículas subátomicas, a las cuales por poseer carga positiva se les llamó protones. Éste y otros descubrimientos condujeron a los químicos a considerar otro modelo del átomo más completo y que incorporara a los protones. En 1911, el modelo atómico de Rutherford sustituye al propuesto seis años atrás por Thomson.
Número atómico
Los científicos comprobaron que los átomos de los elementos tenían un número determinado de protones y electrones. Por ejemplo, los átomos de carbono tienen 6 electrones y 6 protones; los de sodio poseen 23 electrones y 23 protones y, los de aluminio 13 electrones y 13 protones.
El número atómico es una característica particular de los átomos de cada elemento y sirve para identificarlos.
el número de protones que tiene un átomo en el núcleo, se conoce como número atómico. Se representa con la letra Z. El número atómico es lo que distingue a los átomos de un elemento de los de otro. Por ejemplo, el número atómico del hidrógeno es, 1.
Por consiguiente, el átomo de carbono que posee seis electrones y seis protones tiene número atómico, Z, es 6. Este valor suele indicarse mediante un subíndice antes del símbolo de un elemento.
El número atómico se utiliza como criterio para clasificar a los átomos.
en el curso de las investigaciones se fueron acumulando evidencias experimentales que no podían explicarse con el modelo atómico de Dalton.
por ejemplo, en 1897 Joseph John Thompson, físico inglés, demostró la existencia de particulas más pequeñas que exhibían caga negativa, a las cuales denomino electrones. las evidencias experimentales indicaban que los electrones provenían de los atómos, y ponían de manifiesto que el modelo propuesto por Dalton era incorrecto. En 1905, Thomson propone un nuevo modelo atómico.
Un año después el propio Thomson detecta otro tipo de partículas subátomicas, a las cuales por poseer carga positiva se les llamó protones. Éste y otros descubrimientos condujeron a los químicos a considerar otro modelo del átomo más completo y que incorporara a los protones. En 1911, el modelo atómico de Rutherford sustituye al propuesto seis años atrás por Thomson.
Número atómico
Los científicos comprobaron que los átomos de los elementos tenían un número determinado de protones y electrones. Por ejemplo, los átomos de carbono tienen 6 electrones y 6 protones; los de sodio poseen 23 electrones y 23 protones y, los de aluminio 13 electrones y 13 protones.
El número atómico es una característica particular de los átomos de cada elemento y sirve para identificarlos.
el número de protones que tiene un átomo en el núcleo, se conoce como número atómico. Se representa con la letra Z. El número atómico es lo que distingue a los átomos de un elemento de los de otro. Por ejemplo, el número atómico del hidrógeno es, 1.
Por consiguiente, el átomo de carbono que posee seis electrones y seis protones tiene número atómico, Z, es 6. Este valor suele indicarse mediante un subíndice antes del símbolo de un elemento.
El número atómico se utiliza como criterio para clasificar a los átomos.
martes, 11 de enero de 2011
¿ Que es la materia? ( Ana karen Esquivel Gutierrez)
Se dice que la materia es todo lo que ocupa un lugar en el espacio. se llama materia a cualquier tipo de entidad física que es parte del universo observable, tiene energía asociada, es capaz de interaccionar, es decir, es medible y tiene una localización espaciotemporal compatible con las leyes de la física.
Clásicamente se consideraba que la materia tiene tres propiedades que juntas la caracterizan: que ocupa un lugar en el espacio y que tiene masa y duración en el tiempo.
En el contexto de la física moderna se entiende por materia cualquier campo, entidad, o discontinuidad traducible a fenómeno perceptible que se propaga a través del espacio-tiempo a una velocidad igual o inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
La materia puede ser estudiada desde los puntos de vista macroscópico y microscópico.
El nivel microscópico de la materia puede entenderse como un agregado de moléculas. Éstas a su vez son agrupaciones de átomos que forman parte del nivel microscópico. A su vez existen niveles microscópicos que permiten descomponer los átomos en constituyentes aún más elementales, que sería el siguiente nivel son:
Clásicamente se consideraba que la materia tiene tres propiedades que juntas la caracterizan: que ocupa un lugar en el espacio y que tiene masa y duración en el tiempo.
En el contexto de la física moderna se entiende por materia cualquier campo, entidad, o discontinuidad traducible a fenómeno perceptible que se propaga a través del espacio-tiempo a una velocidad igual o inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
La materia puede ser estudiada desde los puntos de vista macroscópico y microscópico.
El nivel microscópico de la materia puede entenderse como un agregado de moléculas. Éstas a su vez son agrupaciones de átomos que forman parte del nivel microscópico. A su vez existen niveles microscópicos que permiten descomponer los átomos en constituyentes aún más elementales, que sería el siguiente nivel son:
- Electrones: partículas leptónicas con carga eléctrica negativa.
- Protones: partículas bariónicas con carga eléctrica positiva.
- Neutrones: partículas bariónicas sin carga eléctrica (pero con momento magnético).
- Sólido: si la energía cinética es menor que la potencial.
- Líquido: si la energía cinética y potencial son aproximadamente iguales.
- Gaseoso: si la energía cinética es mayor que la potencial.
- Plasma: si la energía cinética es tal que los electrones tienen una energía total positiva.
particulas subatomicas
Marin Rodriguez Luis Angel

El átomo, aunque muy estable, dejaba de ser indivisibble y homogéneo.
LAS PARTÍCULAS SUBATÓMICAS
A principios del siglo XX, se realizó el descubrimiento de unas partículas subatómicas.
- Electrón: Se encuentra en la corteza; su masa aproximadamente es de 9,1 . 10-31 kg, casi nula. Tienen carga negativa.
- Protón: Tiene carga positiva igual en magnitud a la carga negativa del electrón. Se encuentran en el núcleo y su masa es de 1,6 . 10-27 kg, aproximadamente 1836 veces la del electrón.
 El número atómico de un elemento indica el número de protones que tiene en el núcleo. Por ejemplo el núcleo del átomo de hidrógeno contiene un único protón.
El número atómico de un elemento indica el número de protones que tiene en el núcleo. Por ejemplo el núcleo del átomo de hidrógeno contiene un único protón. 
- Neutrón:Su masa es igual que la del protón, y a los dos se les puede denominar nucleones. No poseen carga. Y se encuentran en el núcleo.
El átomo, aunque muy estable, dejaba de ser indivisibble y homogéneo.
propiedades de la materia
Marin Rodriguez Luis Angel
Propiedades físicas y químicas de la materia
Hay dos tipos de propiedades que presenta la Materia, Propiedades Extensivas y Propiedades Intensivas. Las Propiedades Extensivas dependen de la cantidad de Materia, por ejemplo, el peso, volumen, longitud, energía potencial, calor, etc. Las Propiedades Intensivas no dependen de la Cantidad de Materia y pueden ser una relación de propiedades, por ejemplo: Temperatura, Punto de Fusión, Punto de Ebullición, Índice de Refracción, Calor Específico, Densidad, Concentración, etc.
Las Propiedades Intensivas pueden servir para identificar y caracterizar una sustancia pura.
Todos los cuerpos tienen masa ya que están compuestos por materia. También tienen peso, ya que son atraídos por la fuerza de gravedad. Por lo tanto, la masa y el peso son dos propiedades diferentes y no deben confundirse. Otra propiedad de la materia es el volumen, porque todo cuerpo ocupa un lugar en el espacio. A partir de las propiedades anteriores surgen, entre otras, propiedades como la impenetrabilidad y la dilatabilidad.
La materia está en constante cambio. Las transformaciones que pueden producirse son de dos tipos:
- Físicas: son aquellas en las que se mantienen las propiedades originales de la sustancia ya que sus moléculas no se modifican.
- Químicas: son aquellas en las que las sustancias se transforman en otras, debido a que los átomos que componen las moléculas se separan formando nuevas moléculas.
Las propiedades físicas de la materia son el conjunto de características que permiten su estudio usando los sentidos o algún instrumento específico. Los científicos se han puesto de acuerdo en determinar que la materia posee ciertas propiedades que son: masa, peso, volumen y densidad.
Masa
En física, masa es la cantidad de materia que constituye un cuerpo determinado. Esta propiedad física no varía jamás, independiente del lugar donde se encuentre el cuerpo o de su volumen. Para medir la masa se utiliza un instrumento llamado balanza. Su valor debe ser expresado siempre en una de estas unidades: tonelada, kilogramo o gramo.
Peso
Esta propiedad física es la fuerza de atracción que ejerce la gravedad sobre la masa de un cuerpo. A diferencia de la masa, esta propiedad varía dependiendo en el lugar donde se encuentre el cuerpo. Por ejemplo, cualquier objeto pesará más si está situado a nivel del mar que si se encuentra en lo alto de una montaña, pero su masa seguirá siendo la misma. Más sorprendente aún es la variación del peso en la Tierra v/s la Luna, ya que en el satélite el peso disminuye considerablemente.
El peso se mide con un instrumento llamado dinamómetro y su unidad se expresa en Newton (N). El dinamómetro está formado por un resorte con un extremo libre y posee una escala graduada en unidades de peso. Para saber el peso de un objeto solo se debe colgar del extremo libre del resorte, el que se estirará; mientras más se estire, más pesado es el objeto.
Volumen
El volumen de un cuerpo es el espacio que éste ocupa. Para medirlo, se debe ver cuantas veces entra en él una unidad de volumen utilizada como unidad de medida. Esta unidad se llama metro cúbico, y corresponde a un cubo de un metro de lado.
Para medir volúmenes mayores y menores que el metro cúbico, se utilizan sus múltiplos y submúltiplos, que aumentan o disminuyen de 1.000 en 1.000. Densidad
Densidad
La densidad es una característica de cada sustancia. Nos vamos a referir a líquidos y sólidos homogéneos. Su densidad, prácticamente, no cambia con la presión y la temperatura; mientras que los gases son muy sensibles a las variaciones de estas magnitudes.
Propiedades físicas y químicas de la materia
Hay dos tipos de propiedades que presenta la Materia, Propiedades Extensivas y Propiedades Intensivas. Las Propiedades Extensivas dependen de la cantidad de Materia, por ejemplo, el peso, volumen, longitud, energía potencial, calor, etc. Las Propiedades Intensivas no dependen de la Cantidad de Materia y pueden ser una relación de propiedades, por ejemplo: Temperatura, Punto de Fusión, Punto de Ebullición, Índice de Refracción, Calor Específico, Densidad, Concentración, etc.
Las Propiedades Intensivas pueden servir para identificar y caracterizar una sustancia pura.
Todos los cuerpos tienen masa ya que están compuestos por materia. También tienen peso, ya que son atraídos por la fuerza de gravedad. Por lo tanto, la masa y el peso son dos propiedades diferentes y no deben confundirse. Otra propiedad de la materia es el volumen, porque todo cuerpo ocupa un lugar en el espacio. A partir de las propiedades anteriores surgen, entre otras, propiedades como la impenetrabilidad y la dilatabilidad.
La materia está en constante cambio. Las transformaciones que pueden producirse son de dos tipos:
- Físicas: son aquellas en las que se mantienen las propiedades originales de la sustancia ya que sus moléculas no se modifican.
- Químicas: son aquellas en las que las sustancias se transforman en otras, debido a que los átomos que componen las moléculas se separan formando nuevas moléculas.
Las propiedades físicas de la materia son el conjunto de características que permiten su estudio usando los sentidos o algún instrumento específico. Los científicos se han puesto de acuerdo en determinar que la materia posee ciertas propiedades que son: masa, peso, volumen y densidad.
Masa
En física, masa es la cantidad de materia que constituye un cuerpo determinado. Esta propiedad física no varía jamás, independiente del lugar donde se encuentre el cuerpo o de su volumen. Para medir la masa se utiliza un instrumento llamado balanza. Su valor debe ser expresado siempre en una de estas unidades: tonelada, kilogramo o gramo.
Peso
Esta propiedad física es la fuerza de atracción que ejerce la gravedad sobre la masa de un cuerpo. A diferencia de la masa, esta propiedad varía dependiendo en el lugar donde se encuentre el cuerpo. Por ejemplo, cualquier objeto pesará más si está situado a nivel del mar que si se encuentra en lo alto de una montaña, pero su masa seguirá siendo la misma. Más sorprendente aún es la variación del peso en la Tierra v/s la Luna, ya que en el satélite el peso disminuye considerablemente.
El peso se mide con un instrumento llamado dinamómetro y su unidad se expresa en Newton (N). El dinamómetro está formado por un resorte con un extremo libre y posee una escala graduada en unidades de peso. Para saber el peso de un objeto solo se debe colgar del extremo libre del resorte, el que se estirará; mientras más se estire, más pesado es el objeto.
Volumen
El volumen de un cuerpo es el espacio que éste ocupa. Para medirlo, se debe ver cuantas veces entra en él una unidad de volumen utilizada como unidad de medida. Esta unidad se llama metro cúbico, y corresponde a un cubo de un metro de lado.
Para medir volúmenes mayores y menores que el metro cúbico, se utilizan sus múltiplos y submúltiplos, que aumentan o disminuyen de 1.000 en 1.000. Densidad
Densidad
La densidad es una característica de cada sustancia. Nos vamos a referir a líquidos y sólidos homogéneos. Su densidad, prácticamente, no cambia con la presión y la temperatura; mientras que los gases son muy sensibles a las variaciones de estas magnitudes.
¿Qué es la materia?
Marin Rodriguez Luis Angel
La materia es un concepto que se utiliza en la ciencia para hacer alusión a la sustancia que compone a los objetos físicos, aquello del lo que está "hecho" el universo observable. Lamentablemente para la ciencia, hay muchas definiciones de materia y no existe una gran claridad al respecto.
Uno de los principios modernos sobre la materia, propuesto por Einstein, es que ésta no se destruye, sino que sólo se transforma, o en términos más precisos, "la masa relativística equivalente" se conserva. Lo anterior nos permite comprender la transición producida de la física clásica a la física moderna, ya que anteriormente se pensaba que la materia y la energía eran dos cosas diferentes que se encontraban a la base de todo fenómeno físico. Sin embargo, la física moderna nos permite comprender que la materia se puede transformar en energía y la energía puede convertirse en materia.
Algo fundamental para la comprensión de lo que es la materia es su composición. En este sentido resulta necesario considerar que existen unas partículas elementales que al encontrarse en conjunto forman átomos. Estos últimos, a su vez, se combinan y forman las denominadas moléculas. La forma en que las diferentes moléculas se combinan, así como su distribución y colocación, permite diferenciar los diferentes estados de la materia y sus propiedades.
Al hablar de lo anterior, nos referimos a los estados de sólido, líquido y gaseoso. Los sólidos poseen la particularidad de resistirse a cualquier cambio de forma debido a que las moléculas por las cuales están constituidos poseen una fuerte atracción entre si. Esto no sucede con los gases y los líquidos, los que debido a una menor atracción entre sus moléculas pueden adoptar cualquier forma. Sin embargo, los líquidos poseen una atracción molecular suficiente que les permite resistirse a experimentar cambios en su volumen. Por su parte, los gases, debido a lo dispersas de sus moléculas no suelen ofrecer grandes resistencias a los cambios de volumen y mucho menos a los cambios de forma, pudiendo modificarse según la forma del recipiente que lo contenga.
También hay muchos fenómenos relacionados con la materia que son bastante misteriosos, por decir lo menos, como en el caso de la luz, que posee una doble naturaleza, comportándose a veces como onda y otras como partícula (materia). Otras formas poco conocidas son la materia oscura en el universo, los neutrinos y el gravitón, por dar ejemplos. Temas tan misteriosos y extensos que darán para otros artículos.
lunes, 10 de enero de 2011
HERNANDEZ MOTA STEPHANIE
¿Que es el atomo?
Del latín atŏmum, un átomo es la cantidad menor de un elemento químico que tiene existencia propia y que está considerada como indivisible. El átomo está formado por un núcleo con protones y neutrones y por varios electrones orbitales, cuyo número varía según el elemento químico.
El átomo también es denominado como la partícula fundamental, gracias a su característica de no poder ser dividido mediante procesos químicos.
Los químicos lograron descubrir que cualquier líquido, gas o sólido podía descomponerse en distintos elementos o constituyentes últimos (por ejemplo, cada molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno: H2O). John Dalton fue quien demostró que los átomos se unían entre sí de acuerdo a ciertas proporciones definidas.
Decíamos al comienzo de esta definición que el núcleo atómico está compuesto por protones y neutrones. Los protones tienen una carga energética positiva, mientras que los neutrones no presentan carga. La diferencia entre los distintos elementos químicos está dada por la cantidad de protones y neutrones de sus átomos. Por otra parte, la cantidad de protones que contiene el núcleo de un átomo recibe el nombre de número atómico.
Historia: modelos atómicos
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles

Tabla 1: Los tres estados de la materia con sus características y transformaciones físicas
Historia: modelos atómicos
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 |  John Dalton |
|
| ||||||
| 1897 |  J.J. Thomson |
|
| ||||||
| 1911 |  E. Rutherford |
|
| ||||||
| 1913 |  Niels Bohr |
|
| ||||||
Materia es todo lo que tiene masa, ocupa espacio y se puede percibir por nuestros sentidos. Gran parte de las cosas necesarias para nuestra vida diaria están compuestas de materia y es la química la que se interesa en la composición y las transformaciones que sufre la materia. El químico estudia las propiedades de la materia para poder identificar, clasificar y dar usos a sus componentes. En este módulo estudiaremos algunos conceptos básicos relacionados con la materia. |
| La materia puede existir en tres estados físicos y pasar de un estado físico a otro sin que cambie su composición (cambio físico), Tabla 1 . Además la materia puede sufrir unos cambios químicos. Los cambios químicos son transformaciones que convierten una sustancia en otra (reacciones químicas). Algunos ejemplos de cambios químicos son el enmohecimiento del hierro y la combustión de una sustancia. |
| Estado | Características | Cambio físico |
| Sólido | Tienen forma y volumen definido | Fusión-cambiar del estado sólido al líquido Sublimación- cambiar del estado sólido al gaseoso |
| Líquido | Tienen volumen definido pero su forma es variable | Congelación- cambiar del estado líquido a sólido Evaporación- cambiar del estado líquido a gaseoso |
| Gas | No tienen forma ni volumen definido: toman la forma y el volumen del envase que los contiene | Condensación- cambiar del estado gaseoso a líquido Deposición- cambiar del estado gaseoso al sólido |
Tabla 1: Los tres estados de la materia con sus características y transformaciones físicas
Suscribirse a:
Entradas (Atom)







