lunes, 9 de mayo de 2011
domingo, 1 de mayo de 2011
pilomeros (Brenda A. Morales)
Los polímeros se producen por la unión de cientos de miles de moléculas pequeñas denominadas monómeros que constituyen enormes cadenas de las formas más diversas. Algunas parecen fideos, otras tienen ramificaciones. Algunas más se asemejan a las escaleras de mano y otras son como redes tridimensionales.
Polímeros naturales: provenientes del reino vegetal o animal, la seda, lana, algodón, celulosa, almidón, proteínas, caucho natural (látex o hule), ácidos nucleicos.
Polímeros semisintéticos: Se obtienen por transformación de polímeros naturales. Por ejemplo, la nitrocelulosa o el caucho vulcanizado.
Polímeros sintéticos: Son los transformados o “creados” por el hombre. Están aquí todos los plásticos, los más conocidos en la vida cotidiana son el nylon, el poliestireno, el policloruro de vinilo (PVC) y el polietileno. La gran variedad de propiedades físicas y químicas de estos compuestos permite aplicarlos en construcción, embalaje, industria automotriz, aeronáutica, electrónica, agricultura o medicina.
nomenclatura de ésteres (MORALES BRENDA)
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.

Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.
Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster

Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster
miércoles, 30 de marzo de 2011
Aminas. [Torres Ortiz Tatiana]
AMINAS.
Se nombran desde la cadena principal donde se encuentra la amina.
Grupo funcional --> NH2
Fórmula general --> CnH2n+3N
Aminas son compuestos derivados del amoniaco (NH3) al sustituir 1, 2 o 3 de sus hidrógenos por radicales alquilícos o aromáticos según el numero de hidrógenos que se sustituyan se denominan aminas:
Primarias: RNH2
Secundarias: R-NH-R'
Terciarias: R-NH-R'
R''
Alquinos. [Torres Ortiz Tatiana]
Regla 1. Los alquinos responden a la fórmula CnH2n-2 y se nombran sustituyendo el sufijo -ano del alca-no con igual número de carbonos por -ino.
Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace.
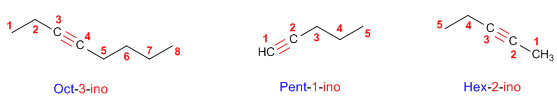
Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc.

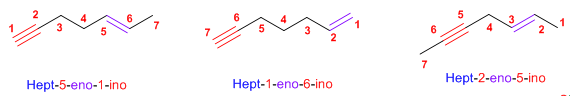
Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno-diino
Alquenos. [Torres Ortiz Tatiana].
Regla 1. Los alquenos son hidrocarburos que responden a la fórmula CnH2n. Se nombran utilizando el mismo prefijo que para los alcanos (met-, et-, prop-, but-....) pero cambiando el sufijo -ano por -eno.
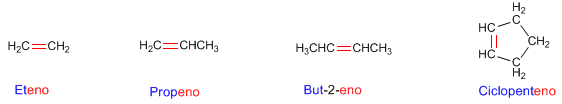
Regla 2. Se toma como cadena principal la más larga que contenga el doble enlace. En caso de tener varios dobles enlaces se toma como cadena principal la que contiene el mayor número de dobles enlaces (aunque no sea la más larga)
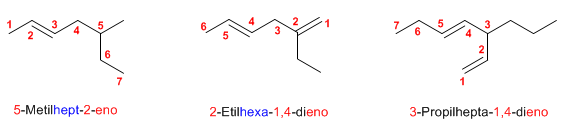
Regla 3. La numeración comienza por el extremo de la cadena que otorga al doble enlace el localizador más bajo posible. Los dobles enlaces tienen preferencia sobre los sustituyentes
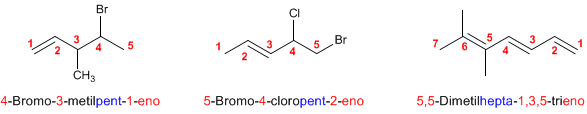
Regla 4. Los alquenos pueden existir en forma de isómeros espaciales que se distinguen con la notación cis/trans.
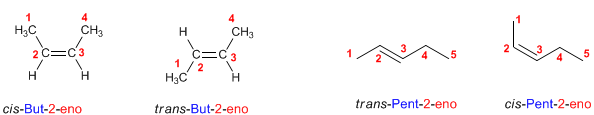
ALCANOS. [TORRES ORTIZ TATIANA].
Los alcanos son compuestos formados por carbonos e hidrogenos con enlaces simples.
Los alcanos se pueden nombrar siguiendo siete etapas:
Regla 1.- Determinar el número de carbonos de la cadena más larga, llamada cadena principal del alcano. Obsérvese en las figuras que no siempre es la cadena horizontal.

El nombre del alcano se termina en el nombre de la cadena principal (octano) y va precedido por los sustituyentes.
Regla 2.- Los sustituyentes se nombran cambiando la terminación –ano del alcano del cual derivan por –ilo (metilo, etilo, propilo, butilo). En el nombre del alcano, los sustituyentes preceden al nombre de la cadena principal y se acompañan de un localizador que indica su posición dentro de la cadena principal. La numeración de la cadena principal se realiza de modo que al sustituyente se le asigne el localizador más bajo posible.

Regla 3.- Si tenemos varios sustituyentes se ordenan alfabéticamente precedidos por lo localizadores. La numeración de la cadena principal se realiza para que los sustituyentes en conjunto tomen los menores localizadores.

Si varios sustituyentes son iguales, se emplean los prefijos di, tri, tetra, penta, hexa, para indicar el número de veces que aparece cada sustituyente en la molécula. Los localizadores se separan por comas y debe haber tantos como sustituyentes.

Los prefijos de cantidad no se tienen en cuenta al ordenar alfabéticamente.
Regla 4.- Si al numerar la cadena principal por ambos extremos, nos encontramos a la misma distancia con los primeros sustituyentes, nos fijamos en los demás sustituyentes y numeramos para que tomen los menores localizadores.

Regla 5.- Si al numerar en ambas direcciones se obtienen los mismos localizadores, se asigna el localizador más bajo al sustituyente que va primero en el orden alfabético.
Regla 6.- Si dos a más cadenas tienen igual longitud, se toma como principal la que tiene mayor número de sustituyentes.

Regla 7.- Existen algunos sustituyentes con nombres comunes aceptados por la IUPAC, aunque se recomienda el uso de la nomenclatura sistemática.

Los nombres sistemáticos de estos sustituyentes se obtienen numerando la cadena comenzando por el carbono que se une a la principal. El nombre del sustituyente se forma con el nombre de la cadena más larga terminada en –ilo, anteponiendo los nombres de los sustituyentes que tenga dicha cadena secundaria ordenados alfabéticamente. Veamos un ejemplo:

Esteres
| Nomenclatura de Ésteres |  |  |
| Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno. Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional. Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......) Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster. |
| Nomenclatura de Ésteres |  |  |
| Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno. Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional. Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......) Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster. |
martes, 29 de marzo de 2011
Poliéster (polímero) Marin Rodriguez Luis Angel
El poliéster (C10H8O4) es una categoría de polímeros que contiene el grupo funcional éster en su cadena principal. Los poliésteres que existen en la naturaleza son conocidos desde 1830, pero el término poliéster generalmente se refiere a los poliésteres sintéticos (plásticos), provenientes de fracciones pesadas del petróleo. El poliéster termoplástio más conocido es el PET. El PET está formado sintéticamente con etilenglicol más tereftalato de dimetilo, produciendo el polímero o poltericoletano. Como resultado del proceso de polimerización, se obtiene la fibra, que en sus inicios fue la base para la elaboración de los hilos para coser y que actualmente tiene múltiples aplicaciones, como la fabricación de botellas de plástico que anteriormente se elaboraban con PVC. Se obtiene a través de la condensación de dioles (grupo funcional dihidroxilo).
Las resinas de poliéster (termoestables) son usadas también como matriz para la construcción de equipos, tuberías anticorrosivas y fabricación de pinturas. Para dar mayor resistencia mecánica suelen ir reforzadas con cortante, también llamado endurecedor o catalizador, sin purificar.
El poliéster es una resina termoestable obtenida por polimerización del estireno y otros productos químicos. Se endurece a la temperatura ordinaria y es muy resistente a la humedad, a los productos químicos y a las fuerzas mecánicas. Se usa en la fabricación de fibras, recubrimientos de láminas, etc.
Las resinas de poliéster (termoestables) son usadas también como matriz para la construcción de equipos, tuberías anticorrosivas y fabricación de pinturas. Para dar mayor resistencia mecánica suelen ir reforzadas con cortante, también llamado endurecedor o catalizador, sin purificar.
El poliéster es una resina termoestable obtenida por polimerización del estireno y otros productos químicos. Se endurece a la temperatura ordinaria y es muy resistente a la humedad, a los productos químicos y a las fuerzas mecánicas. Se usa en la fabricación de fibras, recubrimientos de láminas, etc.
sábado, 19 de febrero de 2011
Grupos o radicales alquilo/alkilo. [ Torres Ortiz Tatiana]
02-02-11
Los grupos o radicales alquilo, son aquellos derivados de los alcanos, a los cuales se les ha quitado un hidrógeno. Su nombre se forma con la raíz del alcano y la terminación -il o -ilo.
Ejemplo:
Metano CH4 --> Metil o Metilo CH3
Carbonos (primarios, secundarios, terciarios y cuaternarios). [ Torres Ortiz Tatiana]
02-02-11
Carbonos primarios son aquellos que se encuentran unidos a un átomo de carbono y contiene tres hidrógenos.
Carbono secundario es aquel que se encuentra unido a dos átomos de carbono y contiene dos hidrógenos.
Carbono terciario es aquel que se encuentra unido a tres átomos de carbono y contiene un hidrógeno.
Carbono cuaternario es aquel que se encuentra unido a cuatro átomos de carbono y no contiene hidrógeno.
- Indicar en la siguiente estructura cuántos y cuáles son los carbonos primarios, secundarios, terciarios y cuaternarios.
1°´s - hay 8 y son: A, C, G, F, K, M, L, H
2°´s - hay 2, son: I, N
3°´s - hay 2, son: B, E
4°´s - hay 2, son: D, J
sábado, 29 de enero de 2011
Regla del octeto (8e-). [ Torres Ortiz Tatiana Arisai]
La regla del octeto, enunciada en 1917 por Gilbert Lewis, dice que la tendencia de los átomos de los elementos del sistema periódico es complementar sus últimos niveles de energía con ocho electrones.
Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos enlaces determinara el comportamiento y las propiedades de las moléculas, estas propiedades dependerán del tipo de enlace, del numero de enlaces por átomo, y de las fuerzas intermoleculares.
Estructura de Lewis. [ Torres Ortiz Tatiana Arisai]
La Estructura de Lewis también llamada diagrama de punto o modelo de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que pueden existir.
El diagrama de Lewis puede ser usado tanto para representar moléculas formadas por la unión de sus átomos mediante enlace covalente.
La estructura de Lewis fue propuesta por Gilbert Lewis, quien la introdujo en 1915 en su articulo La molécula y el átomo.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y lineas que se trazan entre los átomos que se unen entre si. En ocasiones, para representar cada enlace, se usan pares de puntos en lugar de lineas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una linea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
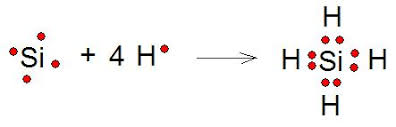
El diagrama de Lewis puede ser usado tanto para representar moléculas formadas por la unión de sus átomos mediante enlace covalente.
La estructura de Lewis fue propuesta por Gilbert Lewis, quien la introdujo en 1915 en su articulo La molécula y el átomo.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y lineas que se trazan entre los átomos que se unen entre si. En ocasiones, para representar cada enlace, se usan pares de puntos en lugar de lineas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una linea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
martes, 18 de enero de 2011
Ejercicios de configuración electrónica normal o basal [Torres Ortiz Tatiana Arisai]
82Pb:〖1s〗^(2 ) 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^2
Escribir la configuración electrónica (normal o basal) de los siguientes elementos:
-Bromo
35Br:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^5
-Magnesio
12Mg:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2
-Renio
75Re:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^5
-Rubidio
37Rb:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^1
-Indio
49In:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^1
-Xenón
54Xe:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6
-Tulio
69Tm:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^13
-Berkelio
97Bk:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^6 〖7s〗^2 〖5f〗^9
-Estaño
50Sn:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^2
-Fosforo
15P:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^3
-Polonio
84Po:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^4
-Bario
56Ba:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2
Escribir la configuración electrónica (normal o basal) de los siguientes elementos:
-Bromo
35Br:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^5
-Magnesio
12Mg:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2
-Renio
75Re:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^5
-Rubidio
37Rb:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^1
-Indio
49In:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^1
-Xenón
54Xe:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6
-Tulio
69Tm:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^13
-Berkelio
97Bk:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^6 〖7s〗^2 〖5f〗^9
-Estaño
50Sn:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^2
-Fosforo
15P:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^3
-Polonio
84Po:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2 〖4f〗^14 〖5d〗^10 〖6p〗^4
-Bario
56Ba:〖1s〗^2 〖2s〗^2 〖2p〗^6 〖3s〗^2 〖3p〗^6 〖4s〗^2 〖3d〗^10 〖4p〗^6 〖5s〗^2 〖4d〗^10 〖5p〗^6 〖6s〗^2
Tipos de Enlace (Ana Karen Esquivel Gutierrez)
En 1916, el químico americano Gilbert Newton Lewis propusó que los enlaces químicos se formaban entre los átomos porque los electrones de los átomos interactuaban entre ellos. Lewis había observado que muchos elementos eran más estables cuando ellos contenían ocho electrones en su envoltura de valencia. El sugirió que los átomos con menos de ocho valencias de electrones se enlazaban para compartir electrones y completar sus envolturas de valencia.
Mientras que algunas de las predicciones de Lewis han sido desde entonces probadas como incorrectas (el sugirió que los electrones ocupaban orbitas en forma de cubos), su trabajo estableció la base de lo que se conoce hoy en día sobre los enlaces químicos. Sabemos que hay dos principales tipos de enlaces químicos, iónicos y - enlaces covalentes
ENLACE IONICO
El enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
ENLACE COVALENTE
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
En realidad, hay dos sub tipos de enlaces covalente. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar .
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos. Los enlaces polares covalentes ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar covalente, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace hidrógeno - oxígeno en la molécula de agua.
Mientras que algunas de las predicciones de Lewis han sido desde entonces probadas como incorrectas (el sugirió que los electrones ocupaban orbitas en forma de cubos), su trabajo estableció la base de lo que se conoce hoy en día sobre los enlaces químicos. Sabemos que hay dos principales tipos de enlaces químicos, iónicos y - enlaces covalentes
ENLACE IONICO
El enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
ENLACE COVALENTE
Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.
En realidad, hay dos sub tipos de enlaces covalente. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar .
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos. Los enlaces polares covalentes ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar covalente, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace hidrógeno - oxígeno en la molécula de agua.
domingo, 16 de enero de 2011
Configuracion electronica. (Marin Rodriguez Luis Angel)
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.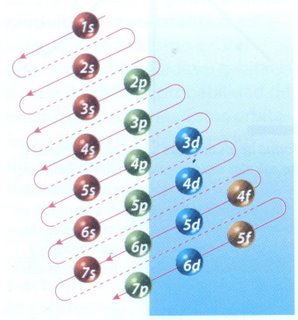

Teoria de la relatividad general. (Marin Eodriguez Luis Angel)

Einstein en el laboratorio
Teoría de la relatividad general
La teoría de la relatividad general se refiere al caso de movimientos que se producen con velocidad variable y tiene como postulado fundamental el principio de equivalencia, según el cual los efectos producidos por un campo gravitacional equivalen a los producidos por el movimiento acelerado.
La revolucionaria hipótesis tomada por Einstein fue provocada por el hecho de que la teoría de la relatividad especial, basada en el principio de la constancia de la velocidad de la luz sea cual sea el movimiento del sistema de referencia en el que se mide (tal y como se demostró en el experimento de Michelson y Morley), no concuerda con la teoría de la gravitación newtoniana: si la fuerza con que dos cuerpos se atraen depende de la distancia entre ellos, al moverse uno tendría que cambiar al instante la fuerza sentida por el otro, es decir, la interacción tendría una velocidad de propagación infinita, violando la teoría especial de la relatividad que señala que nada puede superar la velocidad de la luz.
Tras varios intentos fallidos de acomodar la interacción gravitatoria con la relatividad, Einstein sugirió de que la gravedad no es una fuerza como las otras, sino que es una consecuencia de que el espacio-tiempo se encuentra deformado por la presencia de masa (o energía, que es lo mismo). Entonces, cuerpos como la tierra no se mueven en órbitas cerradas porque haya una fuerza llamada gravedad, sino que se mueven en lo más parecido a una línea recta, pero en un espacio-tiempo que se encuentra deformado por la presencia del sol.
Los cálculos de la relatividad general se realizan en un espacio-tiempo de cuatro dimensiones, tres espaciales y una temporal, adoptado ya en la teoría de la relatividad restringida al tener que abandonar el concepto de simultaneidad. Sin embargo, a diferencia del espacio de Minkowsy y debido al campo gravitatorio, este universo no es euclidiano. Así, la distancia que separa dos puntos contiguos del espacio-tiempo en este universo es más complejo que en el espacio de Minkowsky.
Con esta teoría se obtienen órbitas planetarias muy similares a las que se obtienen con la mecánica de Newton. Uno de los puntos de discrepancia entre ambas, la anormalmente alargada órbita del planeta Mercurio, que presenta un efecto de rotación del eje mayor de la elipse (aproximadamente un grado cada diez mil años) observado experimentalmente algunos años antes de enunciarse la teoría de la relatividad, y no explicado con las leyes de Newton, sirvió de confirmación experimental de la teoría de Einstein.
Un efecto que corroboró tempranamente la teoría de la relatividad general es la deflexión que sufren los rayos de luz en presencia de campos gravitatorios. Los rayos luminosos, al pasar de una región de un campo gravitatorio a otra, deberían sufrir un desplazamiento en su longitud de onda (el Desplazamiento al rojo de Einstein), lo que fue comprobado midiendo el desplazamiento aparente de una estrella, con respecto a un grupo de estrellas tomadas como referencia, cuando los rayos luminosos provenientes de ella rozaban el Sol.
La verificación se llevó a cabo aprovechando un eclipse total de Sol (para evitar el deslumbramiento del observador por los rayos solares, en el momento de ser alcanzados por la estrella); la estrella fue fotografiada dos veces, una en ausencia y otra en presencia del eclipse. Así, midiendo el desplazamiento aparente de la estrella respecto al de las estrellas de referencia, se obtenía el ángulo de desviación que resultó ser muy cercano a lo que Einstein había previsto.
El concepto de tiempo resultó profundamente afectado por la relatividad general. Un sorprendente resultado de esta teoría es que el tiempo debe transcurrir más lentamente cuanto más fuerte sea el campo gravitatorio en el que se mida. Esta predicción también fue confirmada por la experiencia en 1962. De hecho, muchos de los modernos sistemas de navegación por satélite tienen en cuenta este efecto, que de otro modo darían errores en el cálculo de la posición de varios kilómetros.
Otra sorprendente deducción de la teoría de Einstein es el fenómeno de colapso gravitacional que da origen a la creación de los agujeros negros. Dado que el potencial gravitatorio es no lineal, al llegar a ser del orden del cuadrado de la velocidad de la luz puede crecer indefinidamente, apareciendo una singularidad en las soluciones. El estudio de los agujeros negros se ha convertido en pocos años en una de las áreas de estudio de mayor actividad en el campo de la cosmología.
Precisamente a raíz de la relatividad general, los modelos cosmológicos del universo experimentaron una radical transformación. La cosmología relativista concibe un universo ilimitado, carente de límites o barreras, pero finito, según la cual el espacio es curvo en el sentido de que las masas gravitacionales determinan en su proximidad la curvatura de los rayos luminosos. Sin embargo Friedmann, en 1922, concibió un modelo que representaba a un universo en expansión, incluso estático, que obedecía también a las ecuaciones relativistas de Einstein. Con todo, la mayor revolución de pensamiento que la teoría de la relatividad general provoca es el abandono de espacio y tiempo como variables independientes de la materia, lo que resulta sumamente extraño y en apariencia contrario a la experiencia. Antes de esta teoría se tenía la imagen de espacio y tiempo, independientes entre sí y con existencia previa a la del Universo, idea tomada de Descartes en filosofía y de Newton en mecánica.
Teoria de la relatividad. (Marin Rodriguez Luis Angel)

Einstein
Teoría de la relatividad especial
Los postulados de la relatividad especial son dos. El primero afirma que todo movimiento es relativo a cualquier otra cosa, y por lo tanto el éter, que se había considerado durante todo el siglo XIX como medio propagador de la luz y como la única cosa absolutamente firme del Universo, con movimiento absoluto y no determinable, quedaba fuera de lugar en la física, que no necesitaba de un concepto semejante (el cual, además, no podía determinarse por ningún experimento).
El segundo postulado afirma que la velocidad de la luz es siempre constante con respecto a cualquier observador. De sus premisas teóricas obtuvo una serie de ecuaciones que tuvieron consecuencias importantes e incluso algunas desconcertantes, como el aumento de la masa con la velocidad. Uno de sus resultados más importantes fue la equivalencia entre masa y energía, según la conocida fórmula E=mc², en la que c es la velocidad de la luz y E representa la energía obtenible por un cuerpo de masa m cuando toda su masa sea convertida en energía.
Dicha equivalencia entre masa y energía fue demostrada en el laboratorio en el año 1932, y dio lugar a impresionantes aplicaciones concretas en el campo de la física (tanto la fisión nuclear como la fusión termonuclear son procesos en los que una parte de la masa de los átomos se transforma en energía). Los aceleradores de partículas donde se obtiene un incremento de masa son un ejemplo experimental clarísimo de la teoría de la relatividad especial.
La teoría también establece que en un sistema en movimiento con respecto a un observador se verifica una dilatación del tiempo; esto se ilustra claramente con la famosa paradoja de los gemelos: "imaginemos a dos gemelos de veinte años, y que uno permaneciera en la Tierra y el otro partiera en una astronave, tan veloz como la luz, hacia una meta distante treinta años luz de la Tierra; al volver la astronave, para el gemelo que se quedó en la Tierra habrían pasado sesenta años; en cambio, para el otro sólo unos pocos días".
Teoria cuantica (Marin Rodriguez Luis Angel)

La Teoría Cuántica es uno de los pilares fundamentales de la Física actual. Se trata de una teoría que reúne un formalismo matemático y conceptual, y recoge un conjunto de nuevas ideas introducidas a lo largo del primer tercio del siglo XX, para dar explicación a procesos cuya comprensión se hallaba en conflicto con las concepciones físicas vigentes.
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
Las ideas que sustentan la Teoría Cuántica surgieron, pues, como alternativa al tratar de explicar el comportamiento de sistemas en los que el aparato conceptual de la Física Clásica se mostraba insuficiente. Es decir, una serie de observaciones empíricas cuya explicación no era abordable a través de los métodos existentes, propició la aparición de las nuevas ideas.
Hay que destacar el fuerte enfrentamiento que surgió entre las ideas de la Física Cuántica, y aquéllas válidas hasta entonces, digamos de la Física Clásica. Lo cual se agudiza aún más si se tiene en cuenta el notable éxito experimental que éstas habían mostrado a lo largo del siglo XIX, apoyándose básicamente en la mecánica de Newton y la teoría electromagnética de Maxwell (1865).
Bohr (Marin Rodriguez Luis Angel)
Niels Henrik David Bohr (Copenhague, Dinamarca; 7 de octubre de 1885 – ibídem; 18 de noviembre de 1962) fue un físico danés que realizó fundamentales contribuciones para la comprensión de la estructura del átomo y la mecánica cuántica.
Nació en Copenhague, hijo de Christian Bohr, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Mánchester a las órdenes de Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
Después de la guerra, abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en 1962.

Nació en Copenhague, hijo de Christian Bohr, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Mánchester a las órdenes de Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
Después de la guerra, abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en 1962.

Niveles de energia atomicos. (Marin Roriguez Luis Angel)
NIVELES DE ENERGIA.
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Así pues. el átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
Na -> Na+
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Así pues. el átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
Na -> Na+
Orbitales atomicos (Marin Rodriguez Luis Angel)
Los numeros cuanticos son s, p, d, f.
“ n “ = representa los niveles de energía. (desde 1 hasta 7)
“ l “ = representa las formas geométricas de los orbitales (de cero hasta n-1)
“ m “ = representa la orientación en el espacio de estos orbitales (desde – l hasta + l pasando por cero )
“ s” = representa el sentido de giro del electrón sobre su propio eje ( + ½ y – ½
Según el “principio de exclusión de Pauli” solo dos electrones pueden ocupar cada orbital .”.
S : una sola orientación: S : 2 electrones
P: tres orientaciones : Px, Py, Pz : 6 electrones
d: cinco orientaciones: d1, d2, d3, d4, d5 : 10 electr.
f: siete orientaciones: f1…f7 : 14 electrones
1S2
2S2 2P6
3S2 3P6 3d10
4S2 4P6 4d10 4f14
5S2 5P6 5d10 5f 14 5g
6S2 6P6 ---------------------
7S2 ------------------------------
Suscribirse a:
Entradas (Atom)







